我院陳剛教授團(tuán)隊(duì)在外泌體免疫檢查點(diǎn)研究領(lǐng)域取得系列進(jìn)展
外泌體是細(xì)胞主動(dòng)向胞外分泌的納米級(jí)膜性囊泡,可攜帶包括蛋白質(zhì)、核酸、脂質(zhì)在內(nèi)的多種生物活性分子,是胞間通訊的重要介質(zhì)。2018年,我院陳剛教授以第一作者在Nature《自然》雜志發(fā)表里程碑式研究,首次揭示腫瘤細(xì)胞通過(guò)分泌攜帶免疫檢查點(diǎn)分子PD-L1的外泌體,耗竭全身T細(xì)胞抗腫瘤功能,誘發(fā)免疫治療耐受。近一年以來(lái),陳剛教授團(tuán)隊(duì)在Nature子刊Nature Communications《自然-通訊》、Cell子刊Cell Reports《細(xì)胞報(bào)告》、Molecular Therapy《分子治療》等期刊雜志連續(xù)發(fā)表系列研究,系統(tǒng)闡釋了外泌體通過(guò)攜帶PD-L1、PD-1等免疫檢查點(diǎn)分子發(fā)揮免疫抑制作用的多維調(diào)控網(wǎng)絡(luò),為破解腫瘤免疫治療瓶頸提供重要理論支持。
一、外泌體PD-L1的免疫抑制新模式:從適應(yīng)性免疫到固有性免疫
為什么惡性腫瘤患者更容易發(fā)生感染?過(guò)去常規(guī)認(rèn)為這單純是患者"體質(zhì)變差"導(dǎo)致的,但深層機(jī)制尚不明確。陳剛教授團(tuán)隊(duì)在發(fā)表于Cell Reports的研究中,發(fā)現(xiàn)腫瘤細(xì)胞分泌的外泌體PD-L1可通過(guò)PD-1受體下調(diào)肝臟巨噬細(xì)胞BTK/PLCγ2信號(hào)通路,抑制細(xì)胞骨架重組和活性氧爆發(fā),導(dǎo)致機(jī)體細(xì)菌清除能力下降,增加腫瘤患者術(shù)后感染風(fēng)險(xiǎn)。該發(fā)現(xiàn)首次將腫瘤免疫逃逸與繼發(fā)感染相關(guān)聯(lián),通過(guò)探索外泌體PD-L1在腫瘤遠(yuǎn)程誘導(dǎo)巨噬細(xì)胞細(xì)菌清除缺陷中的作用,為認(rèn)識(shí)和干預(yù)腫瘤繼發(fā)感染提供新視角。
 圖1. 腫瘤來(lái)源外泌體PD-L1抑制巨噬細(xì)胞抗菌免疫的作用機(jī)制
圖1. 腫瘤來(lái)源外泌體PD-L1抑制巨噬細(xì)胞抗菌免疫的作用機(jī)制
與此同時(shí),PD-L1在腫瘤細(xì)胞中的內(nèi)源性作用尚未明晰。陳剛教授團(tuán)隊(duì)聯(lián)合北京大學(xué)楊宏宇教授團(tuán)隊(duì)通過(guò)全基因組CRISPR合成致死篩選,突破性發(fā)現(xiàn)PD-L1可入核增強(qiáng)SOD2轉(zhuǎn)錄,通過(guò)清除活性氧抵抗鐵死亡。該研究通過(guò)高通量篩選闡釋了PD-L1的內(nèi)源性作用,并提出阻斷腫瘤細(xì)胞PD-L1入核增強(qiáng)免疫治療的新思路,相關(guān)研究成果發(fā)表于Cell Reports。

圖2. PD-L1抑制腫瘤細(xì)胞鐵死亡的作用機(jī)制
二、外泌體免疫抑制新環(huán)路:從PD-1到PD-L1
除PD-L1以外,外泌體也可攜帶包括PD-1、CD80和CTLA-4在內(nèi)的其他免疫檢查點(diǎn)分子。然而,與PD-L1相比,外泌體攜帶的其它免疫檢查點(diǎn)分子對(duì)腫瘤免疫及免疫治療的作用尚無(wú)定論。陳剛教授團(tuán)隊(duì)系統(tǒng)解析了一系列免疫檢查點(diǎn)分子在循環(huán)外泌體上的表達(dá)情況及其細(xì)胞來(lái)源,并首次發(fā)現(xiàn)T細(xì)胞來(lái)源外泌體可表達(dá)高水平的PD-1,可作用于腫瘤細(xì)胞表面PD-L1觸發(fā)內(nèi)吞作用,同時(shí)激活ESCRT復(fù)合體關(guān)鍵組分HRS,將膜PD-L1以外泌體形式分泌至胞外,進(jìn)而發(fā)揮全身免疫抑制作用以誘導(dǎo)免疫治療耐受。該研究首次揭示了外泌體PD-1/PD-L1介導(dǎo)的腫瘤-免疫反饋性調(diào)節(jié)環(huán)路,為免疫治療療效預(yù)測(cè)提供新型生物標(biāo)志物,并為聯(lián)合治療策略提供新方向,相關(guān)成果發(fā)表于Nature Communications。
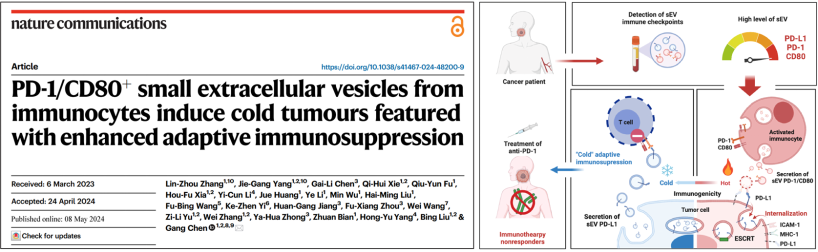
圖3. T細(xì)胞來(lái)源外泌體PD-1介導(dǎo)腫瘤免疫治療耐受的作用機(jī)制
三、增敏免疫治療新策略:外泌體PD-L1小分子抑制劑的高通量篩選與轉(zhuǎn)化
陳剛教授團(tuán)隊(duì)基于前期對(duì)外泌體PD-L1介導(dǎo)免疫治療耐受的作用研究,提出抑制外泌體PD-L1分泌或可增敏免疫治療。為此,該團(tuán)隊(duì)利用腫瘤組織芯片和配對(duì)血液樣本的檢測(cè),證實(shí)HRS是調(diào)控腫瘤細(xì)胞外泌體PD-L1分泌的關(guān)鍵分子,并通過(guò)高通量小分子藥物庫(kù)結(jié)合虛擬篩選與納米檢測(cè)技術(shù),意外發(fā)現(xiàn)布洛芬能夠有效靶向HRS抑制腫瘤外泌體PD-L1分泌并增敏免疫治療。這一系列研究為探究外泌體分泌的精細(xì)機(jī)制及篩選靶向抑制藥物提供新的高通量研究范式,并為增敏免疫治療提供了新策略,相關(guān)研究進(jìn)展相繼發(fā)表于Cancer Immunology Research和Molecular Therapy。

圖4. 高通量藥物篩選靶向抑制外泌體PD-L1增敏免疫治療
陳剛,武漢大學(xué)口腔醫(yī)院副院長(zhǎng)、教授、主任醫(yī)師、博士研究生導(dǎo)師,兼任口頜系統(tǒng)重建與再生全國(guó)重點(diǎn)實(shí)驗(yàn)室/武漢大學(xué)泰康生命醫(yī)學(xué)中心PI、湖北省細(xì)胞外囊泡學(xué)會(huì)理事長(zhǎng)、中華口腔醫(yī)學(xué)會(huì)口腔醫(yī)學(xué)教育專委會(huì)副主任委員、中華口腔醫(yī)學(xué)會(huì)口腔頜面-頭頸腫瘤專委會(huì)委員。國(guó)家優(yōu)秀青年科學(xué)基金和湖北省杰出青年基金獲得者,主要研究方向?yàn)榧?xì)胞外囊泡與腫瘤免疫。以第一或通訊作者(含共同)發(fā)表SCI論文60余篇,包括Nature、Nat Immunol、Nat Commun、Cell Rep Med、Cell Rep、Mol Ther、J Am Chem Soc、Angew Chem Int Ed等國(guó)際權(quán)威期刊。牽頭完成口腔鱗癌新輔助免疫治療隨機(jī)對(duì)照雙臂II期臨床試驗(yàn),目前正在牽頭開(kāi)展多中心III期隨機(jī)對(duì)照臨床試驗(yàn)。已申請(qǐng)國(guó)家發(fā)明專利20項(xiàng)(獲授權(quán)10項(xiàng)),完成1項(xiàng)技術(shù)成果轉(zhuǎn)化,自主創(chuàng)新研發(fā)了全自動(dòng)大規(guī)模外泌體分離設(shè)備,并獲得2023年度湖北省技術(shù)發(fā)明獎(jiǎng)二等獎(jiǎng)。
論文鏈接
3.https://www.nature.com/articles/s41467-024-48200-9
作者:口腔頜面—頭頸腫瘤外科 傅秋云
供圖: 傅秋云
編輯:李賢