重磅!《自然》發(fā)表武漢大學(xué)口腔醫(yī)學(xué)院陳剛副教授最新研究成果 腫瘤免疫逃逸機制及免疫治療研究取得重要突破
格林威治時間2018年8月8日,Nature(《自然》)以“Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response”(外泌體PD-L1介導(dǎo)免疫抑制及預(yù)測PD-1單抗療效)為題,在線發(fā)表了武漢大學(xué)口腔醫(yī)學(xué)院陳剛副教授的最新研究成果。該研究主要由美國賓夕法尼亞大學(xué)、武漢大學(xué)、美國Wistar研究所等相關(guān)團隊合作完成。武漢大學(xué)口腔醫(yī)學(xué)院陳剛副教授為該論文唯一第一作者,美國賓夕法尼亞大學(xué)Wei Guo和Xiaowei Xu教授為該論文共同通訊作者。

惡性腫瘤是目前嚴重威脅人類健康和生命的疾病之一。大多數(shù)惡性腫瘤患者在確診時已處于晚期,失去了手術(shù)機會,且對放化療等保守治療方式不敏感,因此預(yù)后不良。然而,近幾年來免疫治療的興起為晚期惡性腫瘤患者帶來了希望,其中PD-1單克隆抗體(簡稱單抗)是目前腫瘤免疫治療的代表性藥物。PD-1全名為程序性死亡受體-1,主要表達于激活的T細胞表面。PD-L1是PD-1的配體,在正常情況下其功能是與T細胞表面的PD-1結(jié)合,從而抑制T細胞激活,以避免因T細胞過度激活而引起自身免疫病。因此,PD-L1/PD-1在維持機體保護性免疫和免疫耐受平衡中起重要作用。然而,“機智”的腫瘤細胞在其進化過程中選擇性高表達PD-L1,以抑制T細胞功能,使其喪失對腫瘤細胞的殺傷能力,從而實現(xiàn)腫瘤免疫逃逸。PD-1單抗類藥物可特異性阻斷PD-L1與PD-1的結(jié)合,重新激活T細胞,以恢復(fù)后者的腫瘤殺傷作用。PD-1單抗治療與以往的腫瘤治療方式相比,其最大的特點在于:一旦對患者起效,其療效可維持較長時間,甚至可以完全消除腫瘤達到治愈效果。然而,PD-1單抗并非對每一個患者都有效。臨床試驗結(jié)果表明,僅有不到50%的患者能夠從PD-1單抗治療中獲益。加之不僅治療費用高,且治療周期長,若治療無效,患者將喪失及時接受其他治療的時機。更重要的是,免疫治療不良反應(yīng)也仍不容忽視。因此,進一步了解PD-L1/PD-1介導(dǎo)腫瘤免疫逃逸的具體機制,同時尋找能夠在治療早期預(yù)測療效的生物標志物成為了當務(wù)之急。
外泌體是由細胞分泌產(chǎn)生的直徑在50-120 nm的一類細胞外囊泡,攜帶豐富的生物活性分子(如蛋白質(zhì)、RNA等),并可通過自分泌或旁分泌途徑參與對局部或遠處細胞的功能調(diào)控,影響細胞外微環(huán)境。陳剛副教授在其研究中發(fā)現(xiàn),腫瘤細胞可通過釋放表面富含PD-L1的外泌體發(fā)揮對腫瘤殺傷性T細胞的功能抑制作用。該研究分別在轉(zhuǎn)移性惡性黑色素瘤患者及小鼠荷瘤模型中證實,腫瘤細胞分泌的富含PD-L1的外泌體可進入機體外周血并對腫瘤微環(huán)境以外的T細胞起抑制作用,且外周血中PD-L1陽性外泌體的濃度水平與腫瘤大小呈密切正相關(guān)。以往的研究觀點認為PD-L1主要存在于腫瘤細胞的細胞膜上,因此推斷其對T細胞的抑制作用也主要局限于腫瘤微環(huán)境中。該研究則首次證實了PD-L1還大量存在于腫瘤細胞釋放的外泌體膜表面,且其含量遠高于腫瘤細胞膜表面的PD-L1。此外,腫瘤細胞分泌的富含PD-L1的外泌體還可進入機體外周循環(huán)系統(tǒng),并與其中的T細胞接觸同時抑制其功能,以達到全面抑制T細胞功能的目的,從而將PD-L1介導(dǎo)的腫瘤免疫抑制作用拓展到了全身范圍內(nèi)。這一研究成果對目前抑制的腫瘤免疫檢查點調(diào)控機制進行了重要補充,將有助于重新理解腫瘤免疫逃逸機制。
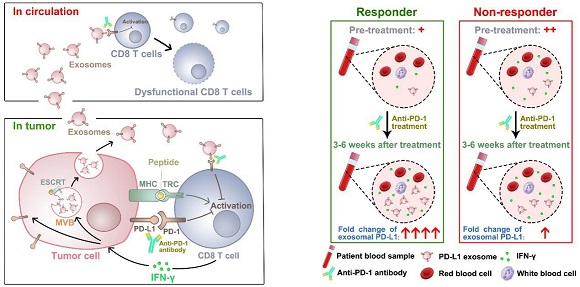
更重要的是,該研究還揭示了腫瘤患者外周血中的PD-L1陽性外泌體的濃度水平及其在PD-1單抗治療早期的變化趨勢和幅度能夠有效評估該患者對治療的反應(yīng)性:治療前外周血中PD-L1陽性外泌體水平高,且治療后3-6周內(nèi)水平較治療前上升幅度不明顯的患者,大多數(shù)對PD-1單抗治療不敏感;治療前外周血中PD-L1陽性外泌體水平低,且治療后3-6周內(nèi)水平較治療前有顯著上升的患者,往往對PD-1單抗治療具有良好反應(yīng)性。基于上述發(fā)現(xiàn),該研究首次提出了一種基于患者循環(huán)外泌體水平來評估免疫治療有效性的液體活檢策略,為早期預(yù)測PD-1單抗治療的療效提供了目前最準確有效和簡便快捷的方法。相關(guān)研究成果已申請國際發(fā)明專利,且部分技術(shù)成果正在轉(zhuǎn)化應(yīng)用過程中。
該研究的共同作者還包括武漢大學(xué)口腔醫(yī)學(xué)院趙怡芳教授及其團隊的青年醫(yī)師張偉、余自力、王蓓克、鐘文群、熊學(xué)鵬,博士生楊解綱、夏厚福、滿其文等。該研究受美國國立衛(wèi)生研究院(National Institutes of Health)、中國國家自然科學(xué)基金、中國科學(xué)協(xié)會“青年人才托舉工程”等基金項目的資助和支持。

陳剛是武漢大學(xué)首屆口腔醫(yī)學(xué)八年制本碩博連讀研究生(2004級),2012年獲醫(yī)學(xué)博士學(xué)位,現(xiàn)為武漢大學(xué)口腔醫(yī)學(xué)院口腔頜面-頭頸腫瘤外科副教授、副主任醫(yī)師。陳剛副教授留校工作后主要從事細胞外囊泡的基礎(chǔ)和應(yīng)用研究,圍繞細胞外囊泡的示蹤成像、致病機制及其生物醫(yī)學(xué)應(yīng)用等方面取得了一系列原創(chuàng)性成果,并先后在武漢大學(xué)化學(xué)與分子科學(xué)學(xué)院(合作導(dǎo)師:龐代文教授)和美國賓夕法尼亞大學(xué)生物學(xué)系(合作導(dǎo)師:Wei Guo教授)從事博士后研究。以第一作者或通訊作者身份發(fā)表SCI論文20余篇,其中包括Angew. Chem. Int. Ed.,J. Am. Chem. Soc.,ACS Nano,Adv. Funct. Mater.,J. Invest. Dermatol.,J. Dent. Res.等期刊雜志,并獲授權(quán)國家發(fā)明專利5項,主持國家自然科學(xué)基金3項,省部級基金2項,入選中國科協(xié)“青年人才托舉工程”和“武漢市中青年醫(yī)學(xué)骨干人才培養(yǎng)工程”。
論文鏈接:https://www.nature.com/articles/s41586-018-0392-8